びまん性神経膠腫(グリオーマ)の概要
●びまん性神経膠腫は最も多い脳腫瘍の一つであり、様々な性質をもった腫瘍が含まれます。
●頭痛や吐き気、痙攣を伴うこともありますが、手足の麻痺や言葉がでにくい失語症状、記憶力や計算力が落ちる高次脳機能障害がでることがあります。
●最新の脳腫瘍分類では、成人に発症するびまん性神経膠腫の多くは星細胞腫(アストロサイトーマ)、乏突起膠細胞腫(オリゴデンドログリオーマ)、膠芽腫(グリオブラストーマ)に分類されます。
●悪性度は様々ですが、いずれの腫瘍も脳にしみこむように成長し、全てを手術で摘出することは難しいことが多いです。
●悪性度が高い膠芽腫は高齢の方に多く、膠芽腫と比較してやや悪性度が低い星細胞腫、乏突起膠細胞腫は若い方に多く発症します。
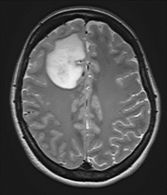

びまん性神経膠腫(グリオーマ)が疑われた場合どうするか?
●CT検査やMRI検査で見つかることが多く、画像検査のみでおおよそ診断できることが多いです。
●典型的ではない場合はPET検査を行うこともあります。
●これらの画像検査でびまん性神経膠腫(グリオーマ)が疑われた場合はまず腫瘍の診断と治療のために手術を行うことを検討します。
●基本的には腫瘍組織の病理診断が悪性度分類に重要であり、悪性度分類はグレード2から4までがあり、4が最も悪性度が高いものになります。
●従来グレードの分類は腫瘍の病理所見で決められてきましたが、近年は遺伝子異常の情報も重要であることがわかり、遺伝子異常も検討することが望ましいです。
●IDH遺伝子という遺伝子に異常がある場合には、比較的おとなしい性質を持つ星細胞腫(アストロサイトーマ)、乏突起膠細胞腫(オリゴデンドログリオーマ)であると考えられますが、これらの腫瘍の悪性度の幅は広く、悪性度が高い腫瘍もあるので注意が必要です。
●IDH遺伝子に異常がない場合は、多くの場合悪性度が高いことが予測され、新しい世界の脳腫瘍分類ではたとえ病理診断が膠芽腫ではなかったとしても、実際には膠芽腫に含まれるという考え方もでてきています。
星細胞腫(アストロサイトーマ)、乏突起膠細胞腫(オリゴデンドログリオーマ)の治療方法
【①手術】
●腫瘍の約8割以上を摘出すると治療成績がよくなることが報告されています。
●安全に8割以上を摘出することが可能であれば、積極的な摘出を目指します。
●手術はナビゲーションシステムを使用しながら、手術中に電気刺激による神経生理学的モニタリングを用いて運動機能等を確認しながら慎重に摘出を行います。
●手術中に全身麻酔を中断し、覚醒状態で言語機能等を確認しながら摘出を行う覚醒下手術も行われます。
●もしも8割以上の摘出が困難と考えられるようであれば、安全な場所から少量の腫瘍を採取し診断をつける生検術を行うこともあります。
【②化学療法・放射線治療】
○星細胞腫
●現在星細胞腫の標準治療を決めるための多くの試験が世界中で行われていますが、今のところ、グレードが3以上であれば膠芽腫に準じたテモゾロミド併用放射線治療が行われることが多いです。
●グレード2であっても残存腫瘍がある場合は放射線治療を検討することもあります。
●IDH遺伝子に変異がない腫瘍の場合は膠芽腫と同様の治療が必要と考えられています。
●IDH遺伝子に変異がなければ、全摘出できたとしてもグレード3であった場合は膠芽腫に準じたテモゾロミド併用の放射線治療を考慮することが多いです。
○乏突起膠腫
●グレード2の場合は多くは摘出後、経過をみて変化があるようであれば追加治療を検討します。
●グレード3の場合は欧米では放射線治療を併用したPCV療法が有用であることが報告され、広く行われています。
●日本ではPCVのC(CCNU)の薬剤が使用できないため、似た薬剤であるACNU(A)もしくはMCNU(M)に変更したPAV, PMV療法が行われます。
●グレード3であればテモゾロミド併用放射線治療も行うことができ、日本では多く行われています。
膠芽腫(グリオブラストーマ)の治療方法
①手術:びまん性神経膠腫をご参照ください。
【②テモダール(テモゾロミド)を併用した放射線治療】
●標準治療はテモダール(テモゾロミド)内服治療を併用した放射線治療を行います。
●放射線治療は平日毎日治療を行い、計30日間程の治療です。
●高齢者の場合は15回ほどに減量した放射線治療でも近い効果が得られることが明らかになり、広く行われつつあります。
●放射線治療終了後は約1ヶ月(28日間)の内にテモダール(テモゾロミド)を5日間内服する維持療法を行います。
【③その他の治療方法】
I. アバスチン(ベバシズマブ)
●膠芽腫(グリオブラストーマ)に対しては再発時に使用すると生存期間が延長します。
●初発時放射線治療時から併用しても生存期間は延長しません。
●ただし、脳浮腫が強く症状が強い場合には初発時でも有効である可能性があります。
II. ギリアデル(カルムスチン脳内留置用剤)
●手術で摘出を行った後に摘出腔の壁にギリアデルを直接置きます。
●現在有効性を確認するための臨床試験(下記JCOG1703試験)が行われています。
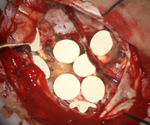
III. オプチューン(電場腫瘍治療)
●電極パッド(アレイ)を頭皮に貼付け、電流を流し続ける治療です。
●テモゾロミド併用放射線治療が終了後、4-7週後より治療を開始します。
●頭皮の皮膚炎には注意が必要ですが、その他には副作用の少ない新しい治療法です。

IV. がんゲノムパネル検査を用いた新規阻害薬治療
●遺伝子検査であるがんゲノムパネル検査が保険診療で行うことができるようになりました。
●脳腫瘍でも治療標的となる遺伝子異常が見つかった場合には治療薬を使える可能性があります。
●膠芽腫(グリオブラストーマ)で条件を満たせば保険診療で使用できる薬剤はキイトルーダ(ペンブロリズマブ)やロズリートレク(エヌトレクチニブ)等が挙げられます。
●その他にも治験や患者申出治療として使用可能な薬剤もあります。

当院で参加することができる膠芽腫(グリオブラストーマ)の臨床試験
●大学病院を中心として日本臨床腫瘍研究グループ(Japan Clinical Oncology Group: JCOG)が構成され様々な臨床試験が行われています。
①再発膠芽腫に対する用量強化テモゾロミド+ベバシズマブ逐次併用療法をベバシズマブ療法と比較する多施設共同ランダム化第III相試験 (JCOG1308C試験)
●再発時にテモゾロミドをより密に内服することでよい効果が出るかを評価する試験です。
②初発膠芽腫に対する可及的摘出術+カルムスチン脳内留置用剤留置+テモゾロミド併用化学放射線療法と可及的摘出術+テモゾロミド併用化学放射線療法のランダム化第III相試験(JCOG1703試験)
●大部分を摘出できた場合にカルムスチン脳内留置用剤を置くことでより良い結果が得られるかどうかを評価する試験です。
③高齢者初発膠芽腫に対するテモゾロミド併用寡分割放射線治療に関するランダム化比較第III相試験 (JCOG1910試験)
●71歳以上の方で回数を減らした放射線治療でも有効な結果が得られるかを評価する試験です。

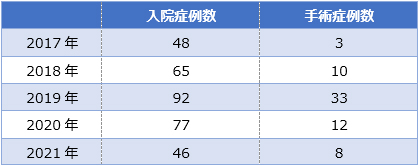
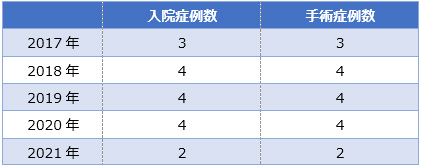
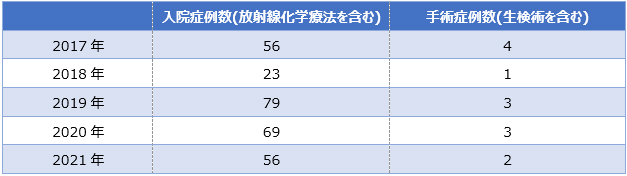
当院での症例数 (2017年-2021年)

中枢神経系原発悪性リンパ腫の概要
●中枢神経原発悪性リンパ腫は脳、脊髄に発生する節外性リンパ腫の一つであり、全脳腫瘍の約3%にみられます。
●高齢の方に多く見られ、高齢化に伴いその発生数が増えてきている腫瘍です。
●手足の麻痺、言葉がでにくい失語症状、記憶力や計算力が落ちる高次脳機能障害、痙攣発作など多様な症状で発症します。

中枢神経系原発悪性リンパ腫が疑われた場合どうするか?
●CT検査やMRI検査で見つかることが多く、画像検査のみでおおよそ診断できることが多いです。
●MRI検査の中でも拡散強調画像(DWI)が診断に有用になります。
●これらの画像検査で中枢神経系原発悪性リンパ腫が疑われた場合は、診断のために、病変の一部を採取する生検術を検討します。
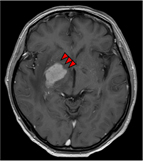
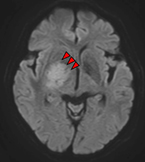
(画像上)造影剤を使用したMRI:均一に造影される病変として描出されることが多い腫瘍です (矢印)
(画像下)拡散強調画像:病変が高信号で描出されることが特徴のひとつです。
中枢神経系原発悪性リンパ腫の治療方法
①生検術
●中枢神経系原発悪性リンパ腫は、放射線化学療法に非常によく反応するため、手術による全摘出を行う必要は基本的にありません。
●病変の一部採取する生検術を検討し、診断の確定をします。
●病変の部位により、神経内視鏡、または生検針を使用した生検術を行います。
②減量放射線R-MPV療法
●初期導入療法として、リツキシマブ (R)、高用量メトトレキサート(M)、プロカルバジン(P)、ビンクリスチン(V)による多剤併用化学療法を行います。14日を1サイクルとし、計5サイクルを行います。
●1サイクルにつき、約1週間の入院が必要になります。
●初期導入療法後は、地固め療法として減量放射線全脳照射を行い、その後シタラビンの投与を行います。
●全ての治療が完了するのに、4ヶ月ほどかかります。
●治療中は、好中球減少、リンパ球減少、ニューモシスチス肺炎の発生に注意が必要です。
③その他の治療方法
I. ベレキシブル(チラブルチニブ)
●再発、難治性の中枢神経系原発悪性リンパ腫に使用が認可されている分子標的薬です。
●当院では、減量放射線R-MPV療法後に再発が認められた場合に使用を検討します。

当院で参加することができる中枢神経系原発悪性リンパ腫の臨床試験
●現在、中枢神経系原発悪性リンパ腫に関して参加可能な臨床試験はありません。

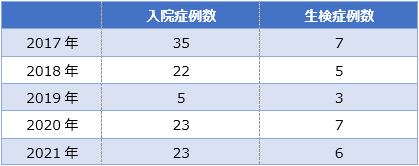
当院での症例数 (2017年-2021年)

転移性脳腫瘍の概要
●10-40%のがん患者さんがその経過中に転移性脳腫瘍を経験すると考えられています。
●転移性脳腫瘍の原発巣として最も多いのは肺がんであり、以下乳がん、大腸がん、腎がんです。
●乳がんからの転移性脳腫瘍は比較的若い方に多いですが、他の原発巣からの転移性脳腫瘍は高齢者に多いです。

転移性脳腫瘍が疑われた場合どうするか?
●麻痺症状やけいれん発作等で発症し、CT検査やMRI検査で見つかることが多く、病歴から総合的に判断することが多いです。
●他の転移巣の検査も含めて全身CT検査やPET検査を行うことが好ましいです。
●がんの既往があり、多発性病変の場合は転移性脳腫瘍が強く疑われるため、非典型的な点がなければ、組織診断は行わずに放射線治療を行うことも多いです。
転移性脳腫瘍の治療方法
●がんの診断としては、転移性脳腫瘍があれば基本的には第IV期となりますので、基本的には放射線治療や化学療法が第一選択になります。
●手術で摘出することで、有効な治療効果をもたらすこともあるので、手術適応を満たす患者さんは積極的に手術を検討する場合もあります。
①手術
●大きな腫瘍であること、かつ基本的には病変は一つであることが手術適応の条件になります。
●病変は一つでなくても一つの大きな病変が強く症状に関与している場合は、その腫瘍の摘出を検討します。
●小脳等にできた腫瘍は水頭症をきたし、生命にかかわることがあるのでやや小さな腫瘍でも摘出を検討する場合があります。
●手術は全身麻酔になりますので、全身状態が落ち着いていることが前提条件になります。
●最近では負担の少ない内視鏡による手術もみられます。
②放射線治療
●放射線治療が標準治療であり、脳全体に放射線を行う全脳照射とピンポイントで転移性脳腫瘍を治療する定位放射線照射に分けられます
●転移性脳腫瘍の数が多い場合、もしくは大きな腫瘍である場合に全脳照射が行われます。
●全脳照射は照射後一定期間が経過後に認知機能低下をおこす可能性がありますが、転移性脳腫瘍の制御ができず悪化した場合にも同様の症状が出るので、慎重な検討が必要です。
●定位放射線照射は腫瘍のみを治療できる有用な治療法ですが、MRIで見えない段階の腫瘍には治療を行うことができず、治療後すぐに新規の病変を認める危険性もあります。
③化学療法
●これまでは脳の中には治療薬は届かないため、化学療法は有効ではないと考えられていました。
●近年新しい分子標的薬がいろいろながん治療で登場しており、一部の薬剤では転移性脳腫瘍に有効であると考えられています。
(EGFR遺伝子異常: ゲフィチニブ、エルロチニブ、アファチニブ ALK遺伝子異常:クリゾチニブ、アレクチニブ、セリチニブ等)
●転移性脳腫瘍による症状がある場合には、手術や放射線治療が優先されますが症状がない場合には転移性脳腫瘍に対しても化学療法を優先してもよいと考えられています。

髄芽腫(メデュロブラストーマ)の概要
●髄芽腫(メデュロブラストーマ)は、主に小児の小脳(平衡運動や協調運動を制御する脳の部分)に発生する悪性度の高い脳腫瘍です。
●日本では年間80〜100人の発生があります。
●発症する年齢は15歳以下が70~80%、ピークは5〜7歳、男児にやや多いです。
●頭痛、嘔吐、意識障害、小脳症状(歩行の不安定や四肢のバランスが取りにくい)で発症することが多いです。
●乳幼児では元気がなく頻回の嘔吐などで発症し、ときに胃腸炎や自家中毒などと診断され見過ごされることもあります。
●乳児では頭囲の拡大がきっかけで発見されることもあります。
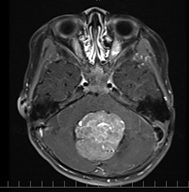

髄芽腫が疑われた場合どうするか?
●CTやMRIなどの画像検査で見つかることが多いです。
●検査で髄芽腫が疑われた場合は、播種(癌が種をまくように散らばること)を調べるために脊髄のMRI検査も行います。
●これらの画像検査で髄芽腫が疑われた場合は、まず腫瘍の診断と治療のために手術を行うことを検討します。
●閉塞性水頭症(腫瘍が脳脊髄液の流出を邪魔することで脳全体に大きな負担がかかる状態)が疑われる場合は、まず水頭症を改善する手術を先行することがあります。

髄芽腫の治療方法
●手術、放射線治療、化学療法による集学的治療が基本となります。
●標準リスク群と高リスク群(3歳未満、術後に腫瘍が多く残っている、播種あり)によって化学療法で使用するお薬や放射線療法の強度が変わってきます。
①手術
●全摘出することを目指しますが、手術による脳損傷が懸念される場合は可及的な摘出となる場合もあります。
②放射線治療
●3歳未満では、照射による脳の障害が強く出るため基本的に放射線治療は行われません。
●放射線治療は平日毎日治療を行い、全脳全脊髄照射を標準リスク群では計13日間、高リスク群では計20-22日間行ったうえで、腫瘍自体の照射も追加して行います。
●放射線治療中にビンクリスチンという抗癌剤を週1回投与します。
③化学療法
●ビンクリスチン、シクロホスファミド、シスプラチンという抗癌剤を使用しますが、高リスク群では抗癌剤の使用量を多くします。
●高リスク群では、末梢血幹細胞移植(幹細胞を患者さんの血液から採取して保存しておき、抗癌剤大量療法の直後に再び患者さんに移植する治療法)を組み合わせることがあります。

当院における髄芽腫の臨床試験
●当院は平成25年2月に小児がん拠点病院に選定され、多くの髄芽腫の患者さんの治療を行っています。
●上記で呈示したような保険診療上認められた標準療法を行いますが、標準治療で治癒しなかったり再発したりする場合があります。
●その場合、当院ではテモゾロミド/ベバシズマブ/イリノテカン3剤併用療法など、倫理的に承認された新規治療を積極的に推進し、これまでほとんど生存が見込めなかった児の予後延長を得ています。

当院での症例数 (2017年-2021年)

胚細胞腫瘍の概要
●原発性脳腫瘍の2.7%、小児脳腫瘍の15.3%の発生頻度で、東アジアに多い腫瘍とされています。若年者に発生し、特に10~19歳の年齢層に多くみられます。
●松果体(70~80%)、下垂体(30%)、基底核(15%)が好発部位です。
●発生部位によりますが、頭痛・嘔気(水頭症による頭蓋内圧亢進症状)、視野異常・複視、ホルモン分泌障害による尿崩症・思春期早発、麻痺、精神症状が認められます。
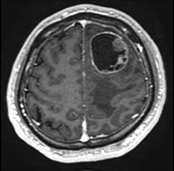
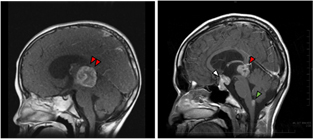
(左)松果体部に発生した卵黄嚢腫(赤矢印)。
(右)松果体部(赤矢印)と下垂体部(白矢印)に発生した胚腫。
このように、複数箇所に発生すること、発症時に播種がみられることもあります。(緑矢印)

胚細胞腫瘍が疑われた場合どうするか?
●CT検査やMRI検査で見つかることが多く、画像検査でおおよその診断ができることが多いです。
●脊髄へ播種することもあり、全脳・全脊髄を対象に画像検査を行います。
●血液検査で腫瘍マーカーとしてAFP、βHCGの上昇がみられることがあります。
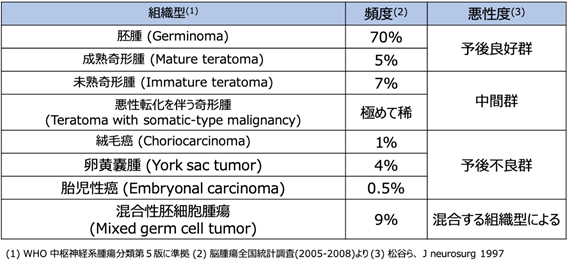
●可能であれば、病変の一部を採取する生検術を行い、診断(組織型:下表)を確定させます。
●画像所見、腫瘍マーカーから診断をつけ、生検術を省略することもあります。

胚細胞腫瘍の治療方法
●組織型により治療法を決定します。
●成熟奇形腫は、放射線療法、化学療法は無効であり、手術による全摘出を目指します。
●成熟奇形腫以外の組織型の場合は、化学療法+放射線治療を行います。
●化学療法+放射線治療後に残存がある場合は、手術による残存病変の全摘出を目指します。
①化学療法
●当院ではシスプラチン(P)、エトポシド(E)によるPE療法、イフォスファミド(I)、カルボプラチン(C)、エトポシド(E)、によるICE療法を行っています。
●組織型によりますが、放射線治療の前に化学療法を2~4サイクル行います。
●放射線治療の後にも同様の化学療法を地固め治療として追加します。
②放射線治療
●病変の広がりに応じて、照射範囲(全脳、全脳室、局所、全脊髄)を決定します。

当院で参加することができる胚細胞腫瘍の臨床試験

その他の脳腫瘍
①上衣腫
●上衣腫は小児に多い脳腫瘍の一つであり、小児では小脳、脳幹部、第4脳室にできることが多いです。
●小脳周辺に発生する場合は、髄芽腫との鑑別が重要になります。
●頻度は少ないですが、大脳に発生することもあり、MRIではグリオーマとの鑑別が困難です。
●小脳、脳幹部、第4脳室に発生する場合はふらつきや水頭症による頭痛、吐き気等で発症することが多いです。
●成人では脊髄に発症することもあります。
●治療は手術で摘出することが基本方針となります。
●腫瘍が残存した場合は、今のところ標準的に行われる化学療法は確立しておらず、放射線治療を行うことが標準的です。
②毛様細胞性星細胞腫
●小児から若年成人に多く見られる腫瘍であり、多くは悪性度の低い腫瘍です。
●視神経や脳幹部、大脳基底核部等に発症することが多く、手術で全摘出が困難な場合もあります。
●視神経に発生する場合は、視力障害をきたす可能性があります。
●神経線維腫症(NF1)に併発して、視神経に毛様細胞性星細胞腫ができることもあります。
●腫瘍はBRAF遺伝子に異常を示す頻度が高く、診断のためには有効です。
●手術で摘出することが最も有効ですが、残った腫瘍が増大するようであればシスプラチンやビンクリスチン等の薬剤を用いた化学療法が行われることもあります。
●放射線治療も行われることがあり、一定以上の効果が得られる可能性が高いですが、視神経等放射線障害も起きやすい場所に発生しますので、注意が必要です。